Por MATTHEW PERRONE da AP
WASHINGTON (AP) – Autoridades de saúde dos Estados Unidos aprovaram na quarta-feira a primeira pílula feita de bactérias saudáveis encontradas em dejetos humanos para combater infecções intestinais perigosas – uma maneira mais fácil de realizar os chamados transplantes fecais.
O novo tratamento da Seres Therapeutics fornece uma versão mais simples e rigorosamente testada de procedimentos baseados em fezes que alguns especialistas médicos usaram por mais de uma década para ajudar os pacientes.
A Food and Drug Administration liberou as cápsulas para adultos com 18 anos ou mais que enfrentam riscos de infecções repetidas por Clostridium difficile, uma bactéria que pode causar náuseas, cólicas e diarreia severas.
C. diff é particularmente perigoso quando ocorre novamente, causando entre 15.000 e 30.000 mortes por ano. Pode ser morto com antibióticos, mas eles também destroem as boas bactérias que vivem no intestino, deixando-o mais suscetível a futuras infecções. As novas cápsulas são aprovadas para pacientes que já receberam tratamento com antibióticos.
Mais de 10 anos atrás, alguns médicos começaram a relatar sucesso com transplantes fecais – usando fezes de um doador saudável – para restaurar o equilíbrio saudável do intestino e prevenir reinfecções.
A FDA aprovou a primeira versão de grau farmacêutico do tratamento no ano passado de uma farmacêutica rival, a Ferring Pharmaceuticals. Mas o produto dessa empresa – como a maioria dos procedimentos originais – deve ser entregue pelo reto.
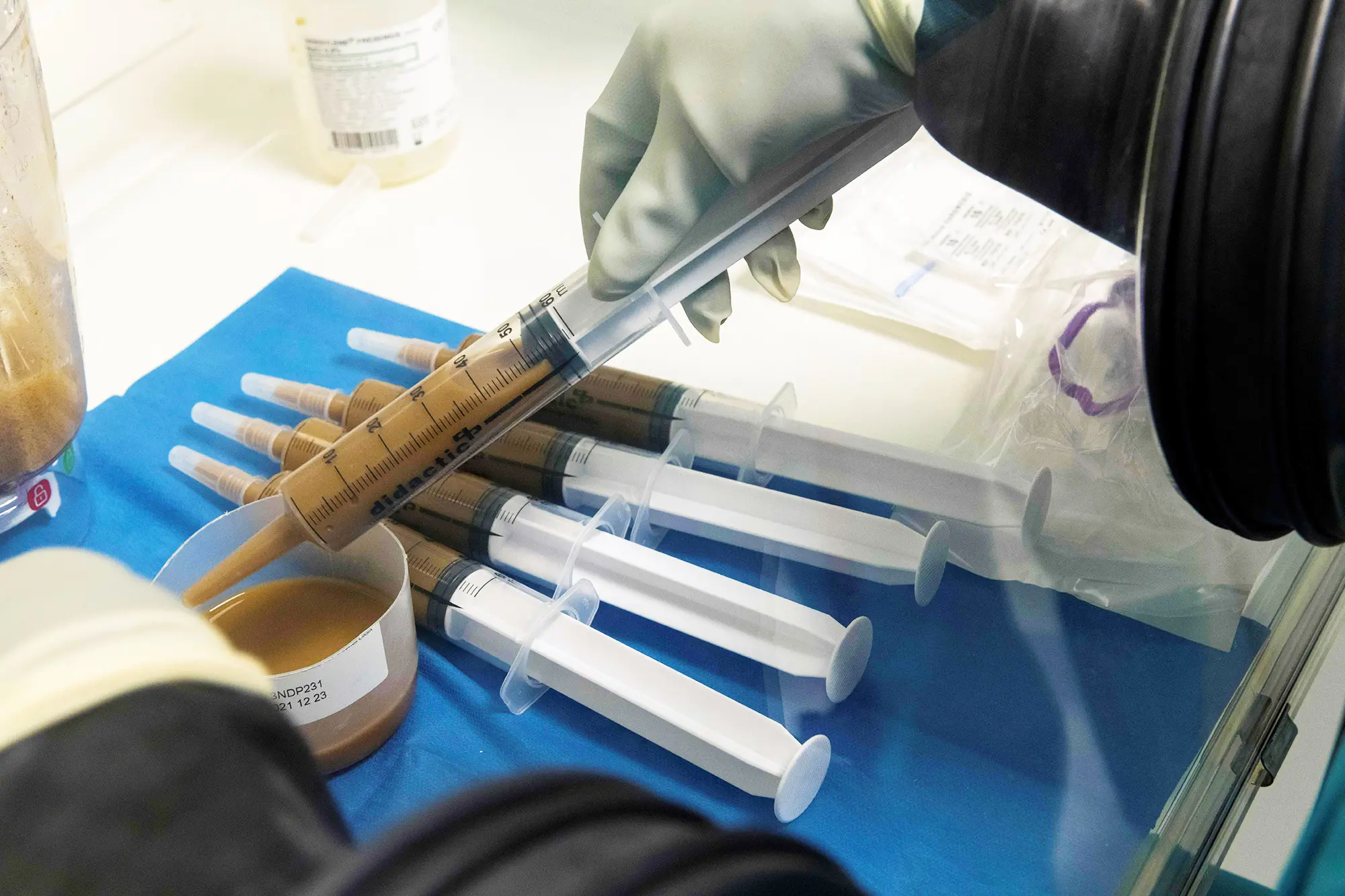
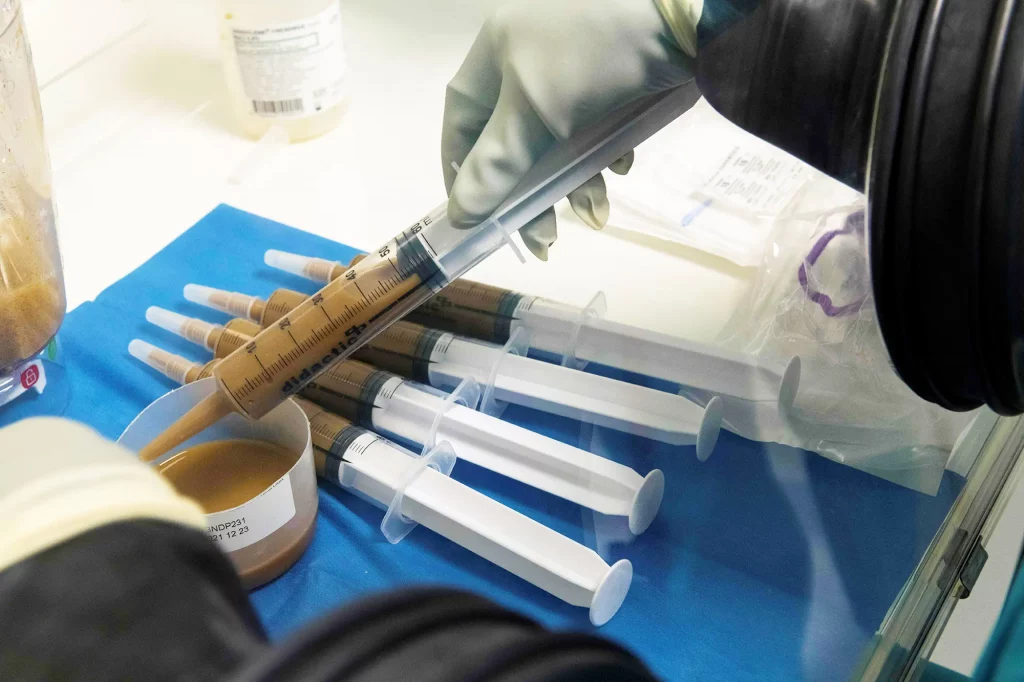
A Seres, com sede em Cambridge, Massachusetts, comercializará seu medicamento como uma opção menos invasiva. O tratamento será vendido sob a marca Vowst e vem como um regime de quatro cápsulas diárias tomadas por três dias consecutivos.
Ambas as aprovações recentes do FDA são o produto de anos de pesquisa da indústria farmacêutica sobre o microbioma, a comunidade de bactérias, vírus e fungos que vivem no intestino.
Atualmente, a maioria dos transplantes fecais é fornecida por uma rede de bancos de fezes que surgiram em instituições médicas e hospitais em todo o país.
Embora a disponibilidade de novas opções aprovadas pela FDA deva diminuir a demanda por doações de bancos de fezes, alguns planejam permanecer abertos.
O OpenBiome, o maior banco de fezes dos EUA, disse que continuará atendendo pacientes que não são elegíveis para os produtos aprovados pela FDA, como crianças e adultos com casos resistentes ao tratamento. Forneceu mais de 65.000 amostras de fezes para pacientes com C. diff desde 2013.
“A OpenBiome está empenhada em manter o acesso seguro ao ‘transplante fecal’ para esses pacientes como uma última linha vital de defesa”, disse o Dr. Majdi Osman, chefe médico do grupo.
O tratamento de fezes padrão da OpenBiome custa menos de US$ 1.700 e normalmente é entregue como uma solução congelada dias após o pedido. A Seres não divulgou o preço que cobrará por suas cápsulas em comunicado na noite de quarta-feira.
“Queremos tornar a experiência comercial para médicos e pacientes o mais fácil possível”, disse Eric Shaff, diretor executivo da empresa, em entrevista antes do anúncio. “A facilidade de administração — em nossa opinião — é um dos aspectos do valor que estamos entregando.”
A Seres co-comercializará o tratamento com a gigante alimentícia suíça Nestlé, que também dividirá os lucros. A Seres receberá um pagamento de US$ 125 milhões da Nestlé em conexão com a aprovação do FDA.
Supervisionar a incipiente indústria de bancos de fezes dos EUA criou dores de cabeça regulatórias para o FDA, que tradicionalmente não policia produtos e procedimentos caseiros usados em consultórios médicos. Nos primeiros dias da tendência, o FDA alertou os consumidores sobre os riscos de possíveis infecções dos transplantes fecais, já que algumas pessoas buscavam métodos questionáveis do tipo “faça você mesmo” em vídeos e sites.
Os executivos da Seres dizem que seu processo de fabricação depende das mesmas técnicas e equipamentos usados para purificar hemoderivados e outras terapias biológicas.
A empresa começa com fezes fornecidas por um pequeno grupo de doadores que são testados para vários riscos e condições de saúde. Suas fezes também são testadas para dezenas de possíveis vírus, infecções e parasitas.
A empresa então processa as amostras para remover os resíduos, isolar as bactérias saudáveis e matar quaisquer outros organismos remanescentes. Milhares de cápsulas podem ser produzidas a partir de cada amostra de fezes, tornando-o um processo mais eficiente do que os transplantes fecais atuais, de acordo com a empresa.
A FDA alertou em seu anúncio de aprovação que o medicamento “pode acarretar o risco de transmissão de agentes infecciosos. Também é possível que Vowst contenha alérgenos alimentares”, observou a agência.
A FDA aprovou o tratamento com base em um estudo de 180 pacientes em que quase 88% dos pacientes que tomaram as cápsulas não apresentaram reinfecção após 8 semanas, em comparação com 60% daqueles que receberam pílulas falsas.
Efeitos colaterais comuns incluíram inchaço abdominal, constipação e diarreia.